지구가 아닌 다른 곳에서도 생명체를 찾을 수 있을까? 많은 과학자들은 물이 존재하는 행성이라면 생명체가 존재할 수도 있다는 의견을 피력해왔다. 현재까지 몇몇 행성들은 수증기가 존재한다는 증거가 발견되었고, 화성에서도 얼음과 수증기가 존재한다는 것이 확인되었다. 물은 어떤 역할을 하기에, 생명체가 생길 수 있는 원천이 되는 걸까?
2022.09.30 - [일반생물학] - [일반생물학 3-1강] 모든 생명에 필수적인 분자: 물
목차
산성과 염기성
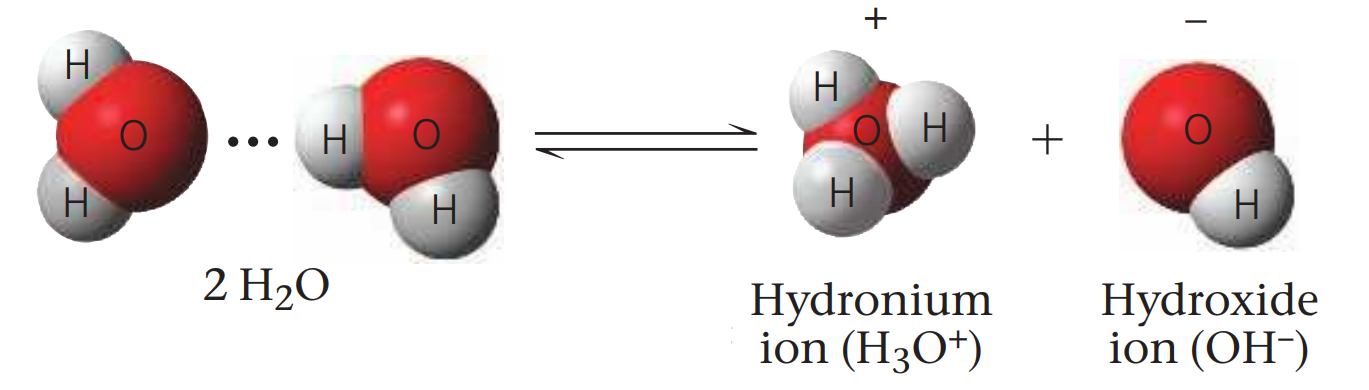
물 분자들끼리 수소 원자가 이전되기도 하면서, 수소이온이 움직여 수산화이온(hydroxide ion, H-)과 하이드로늄이온(hydroniumion, H3O+, H+로 표기할 때도 있음)을 만든다. 평형 상태일 때는 이온화되지 않은 물 분자가 이 이온들보다 훨씬 많으며, 이때, 이런 이온의 농도는 10-7 M이다. 이런 상태를 중성 상태라고 부른다.
이런 수소이온과 수산화이온은 생명체 대해서 큰 역할을 한다. 중성상태를 벗어나 균형이 깨져 산성이나 연기성이 되면, 생명체에 다양한 영향을 준다.
산과 염기
산이나 염기는 물에 녹아 여분의 H+나 OH-를 제공함으로써 용액에 산성이나 염기성을 부여한다.
산(acid)은 예를 들어, 염산, 포름산 등에서 추가적인 H+를 제공함으로써 수소이온이 물 속에서 증가 하게 되어 산성 용액이 된다.
염기(base)는 OH-를 방출하여 H+와 결합함으로써 수소이온의 농도를 줄인다. 수산화나트륨이 그 예이다.
이러한 산성과 염기성을 수치로 표현하기 위한 방법이 바로 pH 척도이다.
pH 척도
과학에 종사하지 않는 사람이라도 pH를 산성비와 리트머스 종이 등에서 들어본 적은 있을 것이다(들어본 적이 없어도 괜찮다!).
앞서 설명한 것처럼, [H+], [OH-]이온의 농도는 각각 10-7일 것이다. 두 이온의 곱은 항상 10-14 M을 유지하며, 일정한 관계를 갖게 된다.
산성 용액의 경우 [H+]의 농도가 증가하여 10-5 M이 된다고 해도 [OH-]의 농도가 떨어져서 10-9 M이 되므로, 그 곱은 항상 일정하게 유지되며, 염기 용액의 경우도 마찬가지이다.
이럴 때, 어떤 pH의 값을 구하는 법은 다음과 같다.

이 공식에 따르면 중성일 때의 값은 7이고, 산성용액일 수록 값이 낮아지게 된다.

이처럼, 여러 용액들은 고유한 pH값을 갖고 있다.

버퍼의 중요성
위의 pH 값에서도 볼 수 있듯이, 우리의 세포나, 몸속은 중성인 7(약 7.4)과 가까운 pH를 유지하고 있다. 이때, 작은 pH의 변화도 생명체에 아주 위험할 수 있다.
하지만, 여기서 생명체의 신비한 점을 발견할 수 있다.
순수한 물(pH 7)에 0.01 M의 강산을 더해주면, pH는 7에서 2로 급격하게 낮아진다. (위의 공식으로 계산을 해봐도 좋다. 진짜다.)
그러나 실제로 혈액에 동일량의 강산을 더해주면, 혈액의 pH는 7.4에서 7.3정도로만 변하게 된다!
어떻게 이런 일이 가능할까?
이는 우리 몸에는 일정량의 버퍼(buffer)가 존재하기 때문이다. 이러한 버퍼는 완충 작용을 하는데, 이런 H+나 OH- 이온의 농도 변화를 최소로 유지시켜 주는 역할을 하는 물질로 정의할 수 있다.
이런 버퍼는 H+의 농도가 낮아지면 H+를 방출함으로써 pH의 급격한 변화를 막게 된다. 우리의 혈액 속에도 이런 버퍼 역할을 해주는 탄산(H2CO3)가 존재하기 때문에, 강산을 떨어뜨리더라도 pH가 크게 변하지 않는 것이다(그래도 물론 몸에 좋지 않다).

산성화의 공포
산업혁명이 인간에 의해 일어나면서, 공장들은 많은 이산화탄소를 대기에 뿜게 되었다. 이런 대기상의 이산화탄소 증가는, 지구온난화 현상과 다양한 이상 기후현상을 일으키고 있는데, 이에 더하여 이산화탄소의 급격한 증가는 생태계에도 직접적으로 악영향을 줄 수 있다.
이산화탄소가 물에 녹게 되면, 물과 반응하여 탄산을 형성하게 되고 결과적으로는 물의 pH를 산성으로 만들게 된다. 이런 물은 비가 되면 산성비라고 불리고, 바다다 강에 떨어져 해양 생태계를 위협하고 있다.
최근 연구 결과에 따르면 해양의 pH는 21세기 말에 0.3~0.5 정도 더 떨어질 것으로 예상된다고 한다.
따라서, 환경파괴에 대한 적절한 해결책을 적시에 내놓지 못하게 된다면, 생태계에 큰 비극을 불러올 것이다.
'일반생물학' 카테고리의 다른 글
| [일반생물학 5-1강] 생물을 이루는 거대 분자 - 탄수화물, 지질 (5) | 2022.10.25 |
|---|---|
| [일반생물학 4강] 탄소와 생물의 분자다양성 (14) | 2022.10.12 |
| [일반생물학 3-1강] 모든 생명에 필수적인 분자: 물 (9) | 2022.09.30 |
| [일반생물학 2-2강] 원자와 분자 - 화학 결합 (7) | 2022.09.22 |
| [일반생물학 2-1강] 원자와 분자 (7) | 2022.09.21 |




댓글