생물학을 이해하기 위해서는 기본적인 화학에 대한 이해는 필수불가결하다. 많은 생물들이 생명활동에 다양한 화합물들을 이용하며, 이런 화합물들은 결국 분자와 원자로 이루어져 있기 때문이다.

화합물을 구성하는 원소
물질을 이루는 원소들은 화합물의 형태로 대부분 존재한다. 자연계에서 발견되는 92개의 원소들 중 20-25%는 생명체가 건강한 생활사를 유지하기 위하여 필수적이다.
모든 생물은 결국 원소로 이루어져 있기 때문에, 화학에 대한 기본적인 이해가 필요하다.

여기서 말하는 원소(element)는 물질을 이루는 기본적인 성분을 나타내는 말이며, 원자(atom)는 물질을 이루는 가장 작은 입자를 뜻한다.
예를 들면, 쌀이 원소이고 쌀 한 톨이 원자라고 생각할 수 있다.
ex) 물은 두 원소 (산소, 수소)로 이루어져 있다; 물은 산소 원자 2개와 수소 원자 1개로 이루어져있다.
원소의 특성과 원자의 구조
각 원소의 특성은 원자의 구조에 의해서 결정된다.
원자는 핵(nucleus)와 전자(electrons)로 이루어져 있고, 핵은 다시 양성자(protons)와 중성자(neutrons)로 이루어져 있다.

양성자와 중성자는 밀집된 핵, 즉 원자핵에 함께 빽빽하게 들어차 있다.
이런 양성자와 중성자는 질량이 거의 비슷하기 때문에 전체 합이 총 원자량(Mass number)을 나타내며, 양성자의 수는 원소의 번호(Atomic number)를 나타낸다. 따라서 양성자와 중성자의 개수에 따라서 원자량과 원소번호가 결정된다.

전자의 에너지 준위
에너지 준위란, 원자와 분자가 갖는 에너지의 값이다. 각 원자의 전자들은 다양한 에너지를 가지고 있는데, 에너지는 간단하게 말해서 '변할 수 있는 힘'이다.
예를들면 폭포가 있을 때, 폭포의 위쪽에 있는 물은 아래로 떨어질 수 있는 힘을 가지고 있는데, 이것도 에너지라고 생각할 수 있다. 이런 에너지를 통해 터빈을 돌려 수력발전을 할 수도 있다.

전자의 에너지 준위는 핵으로부터의 평균 거리와 상관관계가 있다. 전자는 각각 특징적인 평균 거리와 에너지 준위를 가진 서로 다른 전자 껍질(electron shells)에서 발견된다.
닐스 보어의 원자 모형에 따르면, 전자 껍질은 동심원을 가진 원들로 표시할 수 있다.
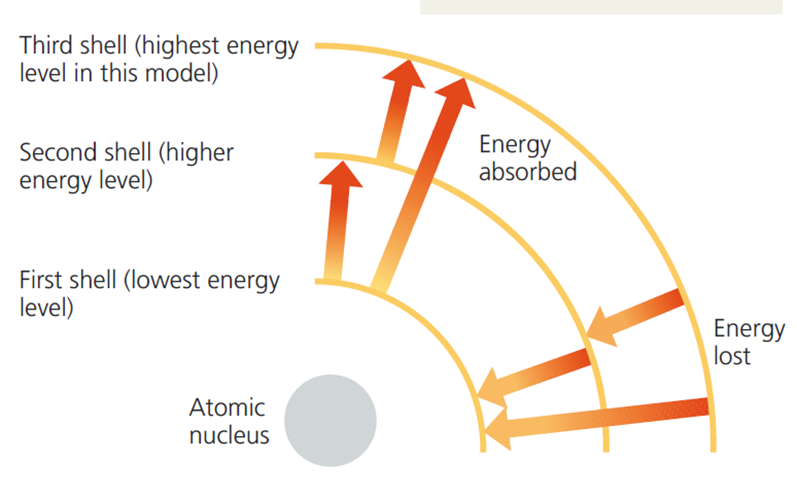
각각의 원소들은 다른 개수의 전자 껍질과 전자를 갖고 있는데, 전자의 개수는 보통 양성자의 개수와 같다(=원소 번호).
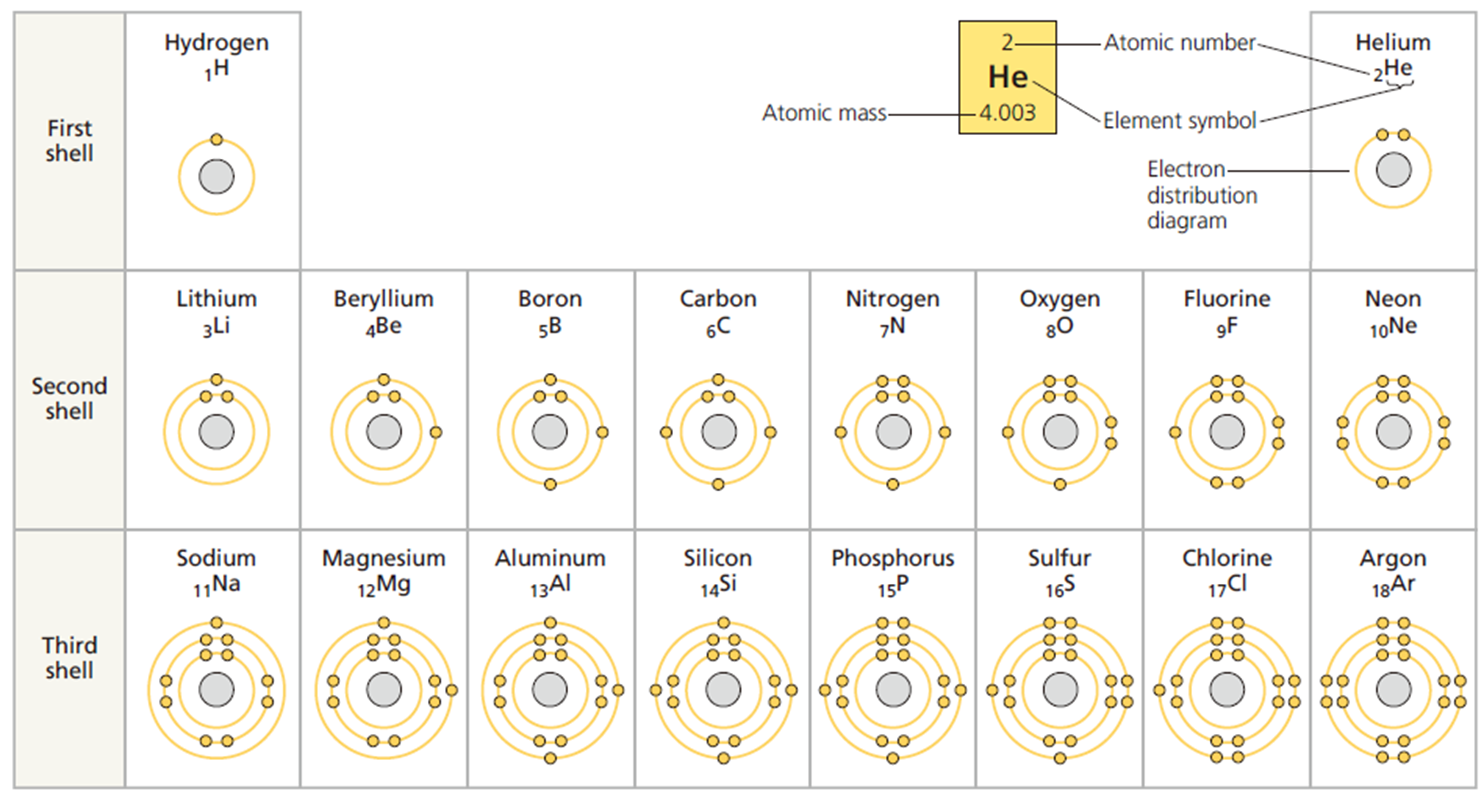
위의 원소 주기율표는 수소(H)에서 아르곤(Ar)까지 처음 18개 원소에 대한 전자 분포를 보여준다. 원소는 원자의 전자껍질 개수에 따라 3열 또는 주기로 배열된다.
그러나 첫 번째 껍질은 2개 이하의 전자를 가질 수 있고, 수소와 헬륨만이 포함된다.
3개 이상의 전자를 가진 원자에서는 이제 첫 번째 껍질이 가득 차 있기 때문에 추가 전자는 더 높은 껍질에 위치해야 한다.
리튬은 3개의 전자를 가지고 있는데, 이 전자들 중 두 개는 첫 번째 껍질을 채우고, 세 번째 전자는 두 번째 껍질을 채운다. 두 번째 껍질은 최대 8개의 전자를 가지고 있다. 예를들어, 네온은 두 번째 줄 끝에 있고, 두 번째 껍데기에 8개의 전자를 가지고 있으며, 총 10개의 전자를 가지고 있다.
원자의 화학적 특징은 대부분 가장 바깥쪽 껍질에 있는 전자의 수에 달려 있다. 주기율표에 같은 열에 이런 원소들이 배치된 것은 우연이 아니다.
오비탈
그러나 현실 세계에서는 전자의 정확한 위치를 파악하는 것은 불가능하다. 우리가 할 수 있는 것은 사실 전자가 위치한 곳의 확률을 표기하는 것 뿐이다.
그래서 전자의 위치가 90%이상인 부분을 3차원으로 표시한 것이 전자 오비탈(electorn orbitals)이다.
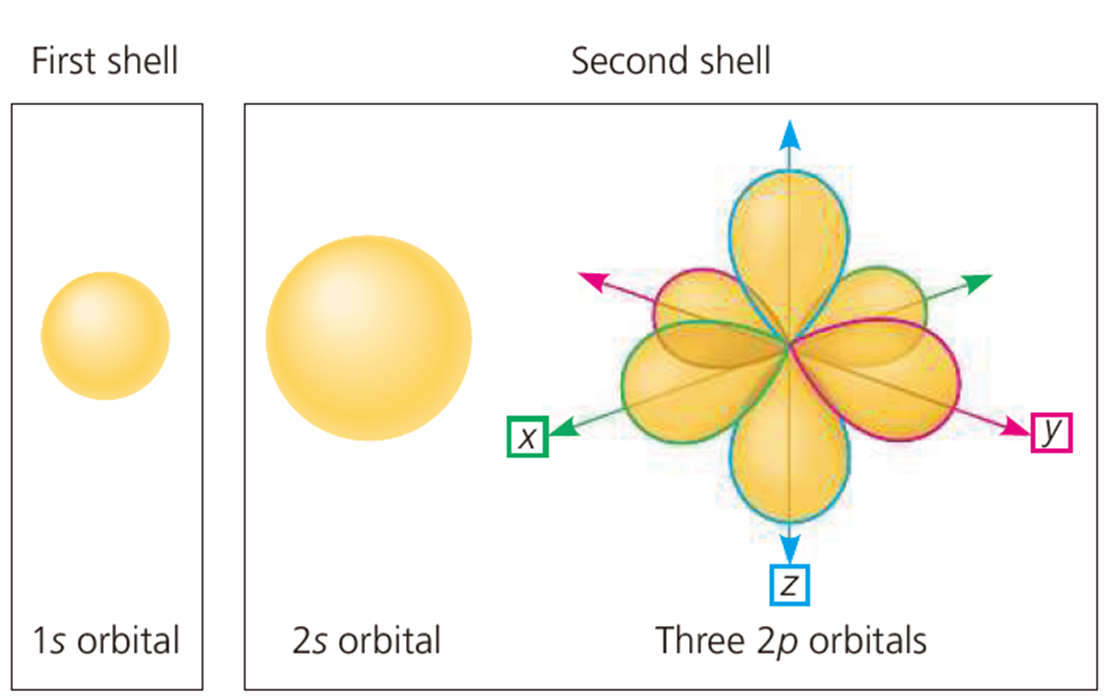
오비탈에 대한 자세한 내용은 다음에 더 다룰 수 있을 것 같다.
마무리
본격적으로 생명활동에 대하여 알아보기 전에, 화학의 기본적인 내용에 대해서 살펴보았다. 각각의 원소의 특징은 분자를 이루거나 화합물으로 결합될 때에 굉장히 중요하다. 따라서 기초적인 수준의 화학적 이해가 동반되어야 한다.
'일반생물학' 카테고리의 다른 글
| [일반생물학 4강] 탄소와 생물의 분자다양성 (14) | 2022.10.12 |
|---|---|
| [일반생물학 3-2강] 물과 생명체, 산과 염기, 산성과 염기성 (8) | 2022.10.03 |
| [일반생물학 3-1강] 모든 생명에 필수적인 분자: 물 (9) | 2022.09.30 |
| [일반생물학 2-2강] 원자와 분자 - 화학 결합 (7) | 2022.09.22 |
| [일반생물학 1강] 생물학이란 무엇인가? (1) | 2022.09.18 |




댓글